Korrosionsbeständigkeit von Metallen
Was ist Korrosionsbeständigkeit?
Die Fähigkeit eines Metalls, Korrosion zu widerstehen, wird als Korrosionsbeständigkeit bezeichnet. Diese Fähigkeit wird durch die Korrosionsrate unter bestimmten Bedingungen bestimmt. Zur Beurteilung des Korrosionsgrades werden quantitative und qualitative Merkmale herangezogen.

Die qualitativen Merkmale sind:
-
Veränderung des Aussehens der Metalloberfläche;
-
Veränderung der Mikrostruktur des Metalls.
Die quantitativen Merkmale sind:
-
Zeit bis zum Auftreten des ersten Korrosionsherdes;
-
die Anzahl der über einen bestimmten Zeitraum gebildeten Korrosionsherde;
-
Metallverdünnung pro Zeiteinheit;
-
Änderung der Metallmasse pro Flächeneinheit pro Zeiteinheit;
-
das während der Korrosion absorbierte oder freigesetzte Gasvolumen pro Oberflächeneinheit und Zeiteinheit;
-
elektrische Stromdichte für eine gegebene Korrosionsrate;
-
Eigenschaftsänderung im Laufe der Zeit (mechanische Eigenschaften, Reflexionsvermögen, elektrischer Widerstand).
Verschiedene Metalle haben eine unterschiedliche Korrosionsbeständigkeit.Um die Korrosionsbeständigkeit zu erhöhen, werden spezielle Verfahren eingesetzt: Legieren von Stahl, Verchromen, Aluminieren, Vernickeln, Lackieren, Verzinken, Passivieren usw.
Eisen und Stahl

In Gegenwart von Sauerstoff und reinem Wasser korrodiert Eisen schnell, die Reaktion läuft nach der Formel ab:
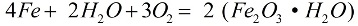
Bei der Korrosion bedeckt das Metall eine lose Rostschicht, die es überhaupt nicht vor weiterer Zerstörung schützt, die Korrosion setzt sich fort, bis das Metall vollständig zerstört ist. Die aktivere Korrosion von Eisen wird durch Salzlösungen verursacht: Wenn auch nur wenig Ammoniumchlorid (NH4Cl) in der Luft vorhanden ist, läuft der Korrosionsprozess viel schneller ab. In einer schwachen Salzsäurelösung (HCl) läuft die Reaktion ebenfalls aktiv ab.
Salpetersäure (HNO3) in einer Konzentration über 50 % führt zur Passivierung des Metalls – es wird mit einer Schutzschicht überzogen, wenn auch brüchig. Verdampfte Salpetersäure ist für Eisen unbedenklich.
Schwefelsäure (H2SO4) in einer Konzentration über 70 % passiviert Eisen, und wenn Stahl der Klasse St3 in 90 %iger Schwefelsäure bei einer Temperatur von 40 °C gelagert wird, dann wird die Korrosionsrate unter diesen Bedingungen 140 Mikrometer pro Jahr nicht überschreiten. Bei einer Temperatur von 90 °C schreitet die Korrosion zehnmal schneller voran. Schwefelsäure mit einer Eisenkonzentration von 50 % löst sich auf.
Phosphorsäure (H3PO4) greift Eisen nicht an, ebenso wenig wie wasserfreie organische Lösungsmittel wie alkalische Lösungen, wässriges Ammoniak, trockenes Br2 und Cl2.
Wenn Sie dem Wasser ein Tausendstel Natriumchromat hinzufügen, wird es wie Natriumhexametaphosphat zu einem hervorragenden Eisenkorrosionshemmer. Chlorionen (Cl-) entfernen jedoch den Schutzfilm vom Eisen und verstärken die Korrosion.Das Eisen ist technisch rein, enthält etwa 0,16 % Verunreinigungen und weist eine hohe Korrosionsbeständigkeit auf.
Mittellegierte und niedriglegierte Stähle
Legierungszusätze von Chrom, Nickel oder Kupfer in niedrig- und mittellegierten Stählen erhöhen deren Beständigkeit gegen Wasser und atmosphärische Korrosion. Je mehr Chrom, desto höher ist die Oxidationsbeständigkeit des Stahls. Wenn der Chromgehalt jedoch weniger als 12 % beträgt, wirken sich chemisch aktive Medien zerstörerisch auf diesen Stahl aus.
Hochlegierte Stähle
Bei hochlegierten Stählen betragen die Legierungsbestandteile mehr als 10 %. Wenn der Stahl 12 bis 18 % Chrom enthält, widersteht dieser Stahl dem Kontakt mit fast allen organischen Säuren, mit Lebensmitteln, ist beständig gegen Salpetersäure (HNO3), Basen und viele Salzlösungen. In 25 %iger Ameisensäure (CH2O2) korrodiert hochlegierter Stahl mit einer Geschwindigkeit von etwa 2 mm pro Jahr. Allerdings zerstören starke Reduktionsmittel, Salzsäure, Chloride und Halogene hochlegierten Stahl.
Rostfreie Stähle, die 8 bis 11 % Nickel und 17 bis 19 % Chrom enthalten, sind korrosionsbeständiger als Stähle mit hohem Chromgehalt allein. Solche Stähle widerstehen sauren oxidierenden Medien wie Chromsäure oder Salpetersäure sowie starken Laugen.
Nickel als Zusatz erhöht die Beständigkeit des Stahls gegenüber nicht oxidierenden Umgebungen und atmosphärischen Faktoren. Aber die Umgebung ist sauer, reduzierend und sauer mit Halogenionen – sie zerstören die passivierende Oxidschicht, wodurch der Stahl seine Säurebeständigkeit verliert.
Edelstähle mit einem Molybdänzusatz in einer Menge von 1 bis 4 % weisen eine höhere Korrosionsbeständigkeit auf als Chrom-Nickel-Stähle.Molybdän verleiht Beständigkeit gegen Schwefel und Schwefelsäure, organische Säuren, Meerwasser und Halogenide.
Ferrosilizium (Eisen mit einem Zusatz von 13 bis 17 % Silizium), der sogenannte Eisen-Silizium-Guss, ist aufgrund des Vorhandenseins eines Oxidfilms aus SiO2 korrosionsbeständig und kann weder durch Schwefelsäure noch durch Salpetersäure oder Chromsäure zerstört werden. Sie verstärken nur diesen Schutzfilm. Aber Salzsäure (HCl) korrodiert Ferrosilicium leicht.
Nickellegierungen und reines Nickel

Nickel ist beständig gegen viele Faktoren, sowohl in der Atmosphäre als auch im Labor, gegen sauberes und Salzwasser, gegen alkalische und neutrale Salze wie Carbonate, Acetate, Chloride, Nitrate und Sulfate. Nicht sauerstoffhaltige und nicht heiße organische Säuren schaden Nickel nicht, ebenso wie siedendes konzentriertes alkalisches Kaliumhydroxid (KOH) in einer Konzentration von bis zu 60 %.
Korrosion wird durch reduzierende und oxidierende Medien, oxidierende alkalische oder saure Salze, oxidierende Säuren wie Stickstoff, feuchte gasförmige Halogene, Stickoxide und Schwefeldioxid verursacht.
Monel-Metall (bis zu 67 % Nickel und bis zu 38 % Kupfer) ist säurebeständiger als reines Nickel, widersteht jedoch der Wirkung stark oxidierender Säuren nicht. Es zeichnet sich durch eine relativ hohe Beständigkeit gegenüber organischen Säuren und einer erheblichen Menge an Salzlösungen aus. Atmosphärische Korrosion und Wasserkorrosion stellen keine Gefahr für Monelmetall dar; Auch Fluorid ist für ihn unbedenklich. Monel-Metall hält 40 % siedendem Fluorwasserstoff (HF) wie Platin sicher stand.
Aluminiumlegierungen und Reinaluminium

Der schützende Oxidfilm von Aluminium macht es beständig gegen übliche Oxidationsmittel, Essigsäure, Fluor, die Atmosphäre allein und eine erhebliche Menge organischer Flüssigkeiten.Technisch reines Aluminium, dessen Verunreinigungen weniger als 0,5 % betragen, ist sehr beständig gegen die Einwirkung von Wasserstoffperoxid (H2O2).
Es wird durch die Einwirkung ätzender Basen in einer stark reduzierenden Umgebung zerstört. Verdünnte Schwefelsäure und Oleum sind für Aluminium nicht schädlich, aber mittelstarke Schwefelsäure zerstört es, ebenso wie heiße Salpetersäure.
Salzsäure kann den schützenden Oxidfilm von Aluminium zerstören. Der Kontakt von Aluminium mit Quecksilber oder Quecksilbersalzen ist für ersteres zerstörerisch.
Reines Aluminium ist korrosionsbeständiger als beispielsweise Duraluminiumlegierungen (in denen bis zu 5,5 % Kupfer, 0,5 % Magnesium und bis zu 1 % Mangan enthalten sind), die weniger korrosionsbeständig sind. Silumin (mit 11 bis 14 % Siliziumzusatz) ist in dieser Hinsicht stabiler.
Kupferlegierungen und reines Kupfer

Reines Kupfer und seine Legierungen korrodieren nicht in Salzwasser oder Luft. Kupfer hat keine Angst vor Korrosion: verdünnte Basen, trockenes NH3, neutrale Salze, trockene Gase und die meisten organischen Lösungsmittel.
Legierungen wie Bronze, die viel Kupfer enthalten, widerstehen der Einwirkung von Säuren, sogar kalter konzentrierter oder heißer verdünnter Schwefelsäure oder konzentrierter oder verdünnter Salzsäure bei Raumtemperatur (25 ° C).
In Abwesenheit von Sauerstoff korrodiert Kupfer bei Kontakt mit organischen Säuren nicht. Weder Fluor noch trockener Fluorwasserstoff haben eine zerstörende Wirkung auf Kupfer.
Aber Kupferlegierungen und reines Kupfer werden durch verschiedene Säuren korrodiert, wenn Sauerstoff vorhanden ist, sowie in Kontakt mit feuchtem NH3, einigen sauren Salzen, feuchten Gasen wie Acetylen, CO2, Cl2, SO2. Kupfer interagiert leicht mit Quecksilber. Messing (Zink und Kupfer) ist nicht sehr korrosionsbeständig.
Weitere Details finden Sie hier – Kupfer und Aluminium in der Elektrotechnik
Reines Zink

Sauberes Wasser greift Zink ebenso wenig an wie saubere Luft. Befinden sich jedoch Salze, Kohlendioxid oder Ammoniak im Wasser oder in der Luft, beginnt die Korrosion von Zink. Zink löst sich in Basen besonders schnell – in Salpetersäure (HNO3), langsamer – in Salz- und Schwefelsäure.
Organische Lösungsmittel und Erdölprodukte haben im Allgemeinen keine korrosive Wirkung auf Zink. Bei längerem Kontakt, beispielsweise mit Crackbenzin, nimmt der Säuregehalt des Benzins zu, da es an der Luft oxidiert und die Korrosion des Zinks beginnt.
Reines Blei

Die hohe Beständigkeit von Blei gegenüber Wasser und atmosphärischer Korrosion ist eine bekannte Tatsache. Es korrodiert nicht ich führe und wenn im Boden. Enthält das Wasser jedoch viel Kohlendioxid, löst sich das Blei darin auf, es entsteht Bleibikarbonat, das bereits löslich ist.
Im Allgemeinen ist Blei sehr beständig gegen neutrale Lösungen, mäßig beständig gegen alkalische Lösungen sowie gegen einige Säuren: Schwefelsäure, Phosphorsäure, Chromsäure und Schwefelsäure. Mit konzentrierter Schwefelsäure (ab 98 %) bei einer Temperatur von 25 °C kann sich Blei langsam auflösen.
Fluorwasserstoff in einer Konzentration von 48 % löst Blei beim Erhitzen auf. Blei reagiert stark mit Salz- und Salpetersäure, mit Ameisen- und Essigsäure. Schwefelsäure bedeckt das Blei mit einer leicht löslichen Schicht aus Bleichlorid (PbCl2), und eine weitere Auflösung findet nicht statt. In konzentrierter Salpetersäure wird das Blei ebenfalls mit einer Salzschicht überzogen, verdünnte Salpetersäure löst das Blei jedoch auf. Chloride, Carbonate und Sulfate sind gegenüber Blei nicht aggressiv, während Nitratlösungen das Gegenteil bewirken.
Reines Titan

Gute Korrosionsbeständigkeit ist ein Markenzeichen von Titan.Es wird nicht durch starke Oxidationsmittel oxidiert, widersteht Salzlösungen, FeCl3 usw. Konzentrierte Mineralsäuren verursachen Korrosion, aber selbst kochende Salpetersäure in einer Konzentration von weniger als 65 %, Schwefelsäure – bis zu 5 %, Salzsäure – bis zu 5 % – führt nicht zu Korrosion von Titan. Die normale Korrosionsbeständigkeit gegenüber Basen, alkalischen Salzen und organischen Säuren unterscheidet Titan von anderen Metallen.
Reines Zirkonium

Zirkonium ist beständiger gegen Schwefel- und Salzsäure als Titan, jedoch weniger beständig gegen Aquaregie und feuchtes Chlor. Es verfügt über eine hohe chemische Beständigkeit gegenüber den meisten Basen und Säuren und ist beständig gegen Wasserstoffperoxid (H2O2).
Die Wirkung bestimmter Chloride, kochender konzentrierter Salzsäure, Königswasser (eine Mischung aus konzentrierter Salpetersäure HNO3 (65–68 Gew.-%) und salzhaltiger HCl (32–35 Gew.-%), heißer konzentrierter Schwefelsäure und rauchender Salpetersäure verursachen In Bezug auf die Korrosion handelt es sich um eine Eigenschaft von Zirkonium wie die Hydrophobie, das heißt, dieses Metall wird weder von Wasser noch von wässrigen Lösungen benetzt.
Reines Tantal

Die ausgezeichnete chemische Beständigkeit von Tantal ähnelt der von Glas. Sein dichter Oxidfilm schützt das Metall bei Temperaturen bis 150 °C vor der Einwirkung von Chlor, Brom, Jod. Die meisten Säuren wirken unter normalen Bedingungen nicht auf Tantal, selbst Aquaregie und konzentrierte Salpetersäure verursachen keine Korrosion. Alkalische Lösungen haben auf Tantal praktisch keinen Einfluss, Fluorwasserstoff wirkt jedoch darauf, und es werden konzentrierte heiße Alkalilösungen verwendet, alkalische Schmelzen werden zum Auflösen von Tantal verwendet.
