Elektronen verhalten sich wie Wellen
Physiker wissen seit langem, dass Licht eine elektromagnetische Welle ist. Bis heute zweifelt niemand an dieser Position, da Licht alle Anzeichen von Wellenverhalten deutlich zeigt: Lichtwellen können sich überlappen und ein Interferenzmuster erzeugen, sie sind auch in der Lage, sich zu trennen und sich entlang der Beugungszeit um Hindernisse herum zu biegen.
Wenn wir einen Vogel sehen, der geht wie eine Ente, schwimmt wie eine Ente und quakt wie eine Ente, nennen wir diesen Vogel eine Ente. So ist das Licht Elektromagnetische Wellebasierend auf objektiv beobachteten Anzeichen des Verhaltens einer solchen Welle im Licht.

Doch im späten 19. und 20. Jahrhundert begannen Physiker, über den „Teilchen-Wellen-Dualismus“ des Lichts zu sprechen. Es stellt sich heraus, dass das Wissen, dass Licht eine elektromagnetische Welle ist, nicht alles ist, was die Wissenschaft über Licht weiß. Wissenschaftler haben eine sehr interessante Eigenschaft des Lichts entdeckt.
Es stellt sich heraus, dass sich Licht irgendwie als das Verhalten eines Teilchenstroms manifestiert.Es wurde festgestellt, dass die vom Licht getragene Energie nach der Zählung über einen bestimmten Zeitraum durch einen speziellen Detektor ohnehin aus einzelnen (ganzen) Teilen besteht.
Daher wurde wahr, dass die Energie des Lichts diskret ist, weil sie sich sozusagen aus einzelnen Teilchen – „Quanten“, also aus kleinsten ganzen Energieanteilen – zusammensetzt. Ein solches Lichtteilchen, das eine Energieeinheit (oder ein Energiequantum) trägt, wurde Photon genannt.
Die Energie eines Photons wird durch die folgende Formel ermittelt:
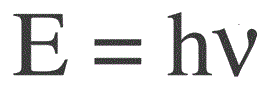
E – Photonenenergie, h – Plancksches Wirkungsquantum, v – Frequenz.
Der deutsche Physiker Max Planck stellte erstmals experimentell die Diskretion der Lichtwelle fest und berechnete den Wert der Konstante h, die in der Formel zur Ermittlung der Energie einzelner Photonen vorkommt. Dieser Wert betrug: 6,626 * 10-34 J * s. Planck veröffentlichte die Ergebnisse seiner Arbeit Ende des 20. Jahrhunderts.

Betrachten Sie zum Beispiel einen violetten Strahl. Die Frequenz dieses Lichts (f oder v) beträgt 7,5 * 1014 Hz, die Plancksche Konstante (h) beträgt 6,626 * 10-34 J * s. Das bedeutet, dass die Energie des für die Farbe Violett charakteristischen Photons (E) 5 * 10-19 J beträgt. Dies ist ein so kleiner Energieanteil, dass er nur sehr schwer einzufangen ist.
Stellen Sie sich einen Gebirgsbach vor – er fließt als eine Einheit und es ist mit bloßem Auge unmöglich zu erkennen, dass der Bach tatsächlich aus einzelnen Wassermolekülen besteht. Heute wissen wir jedoch, dass das makroskopische Objekt Strömung tatsächlich diskret ist, also aus einzelnen Molekülen besteht.
Das heißt, wenn wir einen Molekülzähler neben dem Bach platzieren können, um die vorbeiströmenden Wassermoleküle zu zählen, während der Bach fließt, zählt der Detektor immer nur ganze Zahlen von Wassermolekülen, keine Teilmengen.
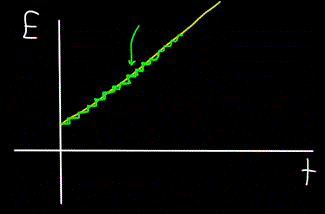
Ebenso wird sich herausstellen, dass der Graph der Gesamtenergie des Photons E, berechnet zum Zeitpunkt t, immer nicht linear (gelbe Abbildung), sondern schrittweise (grüne Abbildung) ist:
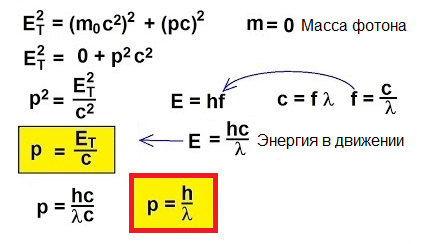
Photonen bewegen sich also, sie transportieren Energie und haben daher einen Impuls. Aber ein Photon hat keine Masse. Wie kann man dann Schwung finden?
Tatsächlich ist die klassische Formel p = mv für Objekte, die sich mit Geschwindigkeiten nahe der Lichtgeschwindigkeit bewegen, einfach nicht anwendbar. Um zu verstehen, wie man in diesem ungewöhnlichen Fall den Impuls findet, wenden wir uns der speziellen Relativitätstheorie zu:
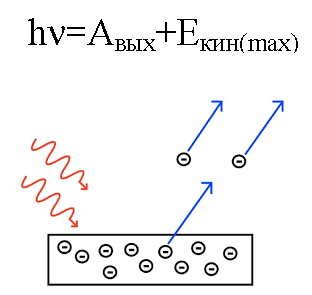
Albert Einstein erklärte 1905 aus dieser Sicht photoelektrischer Effekt… Wir wissen, dass sich in der Metallplatte Elektronen befinden, die von den positiv geladenen Kernen der Atome angezogen werden und daher im Metall festgehalten werden. Aber wenn man eine solche Platte mit Licht einer BESTIMMTEN Frequenz beleuchtet, kann man Elektronen aus der Platte herausschlagen.
Es ist, als ob sich Licht wie ein Teilchenstrom mit Impuls verhält. Und obwohl ein Photon keine Masse hat, interagiert es dennoch irgendwie mit einem Elektron in einem Metall, und unter bestimmten Bedingungen ist ein Photon in der Lage, ein Elektron herauszuschlagen.
Wenn also ein auf die Platte einfallendes Photon genügend Energie hat, wird das Elektron aus dem Metall herausgeschlagen und bewegt sich mit der Geschwindigkeit v aus der Platte. Ein solches herausgeschlagenes Elektron nennt man Photoelektron.
Da das herausgeschlagene Elektron eine bekannte Masse m hat, wird es eine bestimmte kinetische Energie mv haben.
Die Energie des Photons, wenn es auf das Metall einwirkt, wird in die Energie des Austritts des Elektrons aus dem Metall (Austrittsarbeit) und in die kinetische Energie des Elektrons umgewandelt, die das ausgeschlagene Elektron besitzt und sich zu bewegen beginnt aus dem Metall, es verlassen.
Angenommen, ein Photon bekannter Wellenlänge trifft auf die Oberfläche eines Metalls, dessen Austrittsarbeit (eines Elektrons vom Metall) bekannt ist. In diesem Fall kann die kinetische Energie eines von einem bestimmten Metall emittierten Elektrons sowie seine Geschwindigkeit leicht ermittelt werden.
Wenn die Energie des Photons nicht ausreicht, damit das Elektron die Austrittsarbeit ausführen kann, kann das Elektron die Oberfläche des gegebenen Metalls einfach nicht verlassen und das Photoelektron wird nicht gebildet.
1924 ein französischer Physiker Louis de Broglie eine bahnbrechende Idee vorbringen, wonach Nicht nur Lichtphotonen, sondern auch Elektronen selbst können sich wie Wellen verhalten. Der Wissenschaftler hat sogar eine Formel für die hypothetische Wellenlänge des Elektrons abgeleitet. Diese Wellen wurden später „de Broglie-Wellen“ genannt.
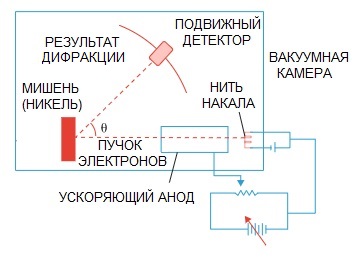
De Broglies Hypothese wurde später bestätigt. Ein physikalisches Experiment zur Elektronenbeugung, das 1927 von den amerikanischen Wissenschaftlern Clinton Davison und Lester Germer durchgeführt wurde, wies schließlich auf die Wellennatur des Elektrons hin.
Wenn ein Elektronenstrahl durch eine spezielle Atomstruktur geleitet wurde, hätte der Detektor das Bild anscheinend als nacheinander fliegende Teilchen aufzeichnen sollen, was logischerweise zu erwarten wäre, wenn Elektronen Teilchen wären.
Aber in der Praxis haben wir ein für die Wellenbeugung charakteristisches Bild. Darüber hinaus stimmen die Längen dieser Wellen vollständig mit dem von de Broglie vorgeschlagenen Konzept überein.
Letztendlich ermöglichte de Broglies Idee, das Prinzip von Bohrs Atommodell zu erklären, und später ermöglichte sie es Erwin Schrödinger, diese Ideen zu verallgemeinern und die Grundlagen der modernen Quantenphysik zu legen.
