Was ist der Unterschied zwischen Graphen und Graphit?
Kohlenstoff ist ein bemerkenswertes chemisches Element und steht praktischerweise auf Platz 6 der vierzehnten Gruppe der zweiten Periode des Periodensystems der chemischen Elemente. Seit der Antike kennen die Menschen Diamant und Graphit, zwei der mehr als neun bisher entdeckten allotropen Modifikationen dieses Elements. Übrigens ist es Kohlenstoff, der im Vergleich zu anderen Substanzen die größte Anzahl allotroper Modifikationen aufweist, die der modernen Wissenschaft bekannt sind.
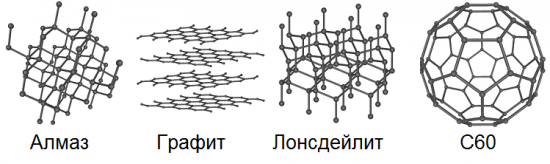
Allotropie impliziert die Möglichkeit der Existenz desselben chemischen Elements in der Natur in Form von zwei oder mehr einfachen Substanzen, den sogenannten allotropen Formen oder allotropen Modifikationen, die zu Unterschieden in diesen Substanzen sowohl in der Struktur als auch in den Eigenschaften führen. Kohlenstoff hat also 8 solcher Grundformen: Diamant, Graphit, Lonsdaleit, Fullerene (C60, C540 und C70), amorpher Kohlenstoff und einwandige Nanoröhren.
Unter diesen Kohlenstoffformen gibt es völlig unterschiedliche Eigenschaften und Charaktere: weiche und harte, transparente und undurchsichtige, billige und teure Stoffe. Vergleichen wir jedoch zwei ähnliche Kohlenstoffmodifikationen – Graphit und Graphen.

Wir alle kennen Graffiti seit der Schule.Die Mine eines gewöhnlichen Bleistifts besteht genau aus Graphit. Es fühlt sich recht weich, rutschig und fettig an, die Kristalle sind Platten, die Atomschichten liegen übereinander, daher lösen sich beim Reiben beispielsweise auf Papier leicht einzelne Flocken der geschichteten Kristallstruktur des Graphits und hinterlässt eine charakteristische dunkle Spur auf dem Papier.
Graphit leitet elektrischen Strom gut, sein Widerstand beträgt durchschnittlich 11 Ohm * mm2/m, die Leitfähigkeit von Graphit ist jedoch aufgrund der natürlichen Anisotropie seiner Kristalle nicht gleich. Somit ist die Leitfähigkeit entlang der Kristallebenen hundertmal höher als die Leitfähigkeit in diesen Ebenen. Die Dichte von Graphit beträgt 2,08 bis 2,23 g/cm3.
In der Natur entsteht Graphit bei hohen Temperaturen in magmatischen und vulkanischen Gesteinen, in Skarnen und Pegmatiten. Es kommt in Quarzgängen mit Mineralien in hydrothermischen polymetallischen Lagerstätten mittlerer Temperatur vor. Es ist in metamorphen Gesteinen weit verbreitet.
So wurden seit 1907 auf der Insel Madagaskar die weltweit größten Reserven an natürlichem Flockengraphit erschlossen. Die Insel besteht aus präkambrischen metamorphen Gesteinen, die in einem bergigen Gelände mit hypsometrischen Markierungen von 4.000 bis 4.600 Fuß an die Oberfläche ragen. Der Graphit kommt hier in einem 400 Meilen langen Gürtel vor und dominiert die Berge im östlichen Teil der Inselmitte.
Graphen hat im Gegensatz zu Graphit keine massive Kristallstruktur; Es verfügt über ein zweidimensionales sechseckiges Kristallgitter, nur ein Atom dick. In einer solchen allotropen Modifikation kommt Kohlenstoff in der Natur überhaupt nicht vor, kann aber theoretisch künstlich gewonnen werden. Wir können sagen, dass es sich bei einer Ebene, die bewusst von der mehrschichtigen Massenkristallstruktur des Graphits getrennt ist, um eben dieses Graphen handelt.
Aufgrund der Instabilität der Materie in dieser Form war es den Wissenschaftlern zunächst nicht möglich, Graphen in Form eines einfachen zweidimensionalen Films zu erhalten. Auf einem Siliziumoxidsubstrat (aufgrund der Bindung mit der dielektrischen Schicht) war es jedoch immer noch möglich, ein Atom dickes Graphen zu erhalten: 2004 veröffentlichten die russischen Wissenschaftler Andrey Geim und Konstantin Novoselov von der Universität Manchester einen Bericht in Science über die Gewinnung von Graphen auf diesem Weg.
Und auch heute noch haben solch einfache Methoden zur Gewinnung von Graphen für Forschungszwecke ihre Berechtigung, wie beispielsweise das mechanische Ablösen einer Kohlenstoffmonoschicht von einem Graphit-Volumenkristall mithilfe von Klebeband (und ähnlichen Methoden).
Die Forscher glauben, dass dank ihrer Fortschritte bald eine neue Klasse graphenbasierter Nanoelektronik entstehen wird, bei der Feldeffekttransistoren weniger als 10 nm dick sein werden. Tatsache ist, dass die Elektronenmobilität in Graphen so hoch ist (10.000 cm2/V*s), dass es heute die vielversprechendste Alternative zu herkömmlichem Silizium zu sein scheint.
Unter hoher Ladungsträgermobilität versteht man die Fähigkeit von Elektronen und Löchern, extrem schnell auf die Wirkung angelegter elektrischer Felder zu reagieren. Dies ist äußerst wichtig für Feldeffekttransistoren, die grundlegende Funktionseinheit moderner Elektronik.
Es bestehen auch Aussichten für die Entwicklung verschiedener biologischer und chemischer Sensoren sowie dünner Filme für Photovoltaikgeräte und Touchscreens. Trotz alledem ist die Wärmeleitfähigkeit von Graphen zehnmal höher als die von Kupfer, und dieses Kriterium ist für die Elektronik immer sehr wichtig.