Metallreinigung und andere Anwendungen des elektrochemischen anodischen Ätzens
Es gibt eine Reihe von Verfahren zur elektrochemischen Behandlung von Metallen, um Metallteilen die erforderliche Form, Größe oder Oberflächenschichtqualität zu verleihen. Diese Verarbeitung erfolgt in Elektrolyseuren, das sind spezielle Elektrolytbäder, Zellen, Anlagen und ganze Maschinen. Beim elektrochemischen anodischen Ätzen erfolgt die lokale oder vollständige Auflösung des Metalls durch Umwandlung seiner äußeren Schicht in ein Oxid oder eine andere leicht lösliche Verbindung.
Das elektrochemische Ätzen umfasst mehrere Technologien, die direkt auf der anodischen Auflösung des Metalls basieren. Mit diesem Verfahren werden die Oberflächen unterschiedlichster Metallteile, Drähte, Rohre, Bänder von eventuellen Oxiden, Fetten und anderen Verunreinigungen gereinigt, um anschließend eine hochwertige Beschichtung aufzutragen, zu walzen oder andere Arbeiten durchzuführen notwendiger technologischer Prozess, der eine chemisch saubere Oberfläche erfordert.
Bei der Reinigung von Oberflächen von Verunreinigungen durch elektrochemisches Ätzen findet dieser chemische Prozess üblicherweise in einer sauren Lösung, meist unter Zusatz von Korrosionsinhibitoren, oder in einer alkalischen Lösung statt oder wird unter Einwirkung von Gleich- oder Wechselstrom in die Dicke eingeschmolzen des Arbeitsmediums.
Nahezu jede Legierung und jedes Metall kann elektrochemisch geätzt werden. Auf diese Weise wird elektrochemisches Fräsen durchgeführt, um durch lokale anodische Auflösung des Metalls das gewünschte Oberflächenmuster des Metallteils zu erhalten. Bereiche des Teils, die sich nicht auflösen dürfen, werden vor dem Ätzen mit einer Fotolackschicht oder einem chemisch beständigen Muster geschützt.
Auf diese Weise erfolgt beispielsweise die Bearbeitung von Leiterplatten. Auf die gleiche Weise werden Bleche perforiert und sogar dekorative Muster auf Metallprodukten angebracht. Durch anodisches Ätzen können gezackte oder abgerundete scharfe Kanten an einem Teil entfernt werden.
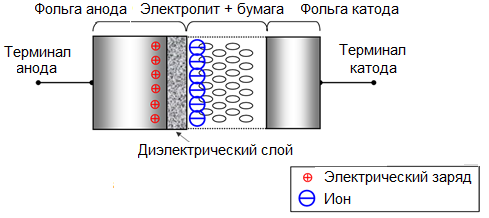
Ein wichtiges Anwendungsgebiet des elektrochemischen Ätzens ist die Vergrößerung der spezifischen Oberfläche des Metalls. Das Ätzen von Aluminiumfolie in Chloridlösungen wird in der Elektroindustrie häufig zur Herstellung von Elektrolytkondensatoren eingesetzt. In diesem Fall vergrößert sich die spezifische Arbeitsfläche der Folie um das Hundertfache und dementsprechend erhöht sich die spezifische elektrische Kapazität der Kondensatoren, und die Größe des Kondensators fällt kleiner aus, als sie ohne Bearbeitung der Folie sein könnte.
Die Entwicklung von Oberflächen durch elektrochemisches Ätzen trägt dazu bei, die Haftung von Metall auf Keramik- oder Glasoberflächen in der Elektronik zu verbessern, fördert das hochwertige Aufbringen einer Kopierschicht auf eine Druckplatte in der Druckindustrie und ermöglicht eine Stärkung der Haftung von Emaille auf Metall beim Emaillieren von Metallprodukten usw.
Darüber hinaus trägt das anodische Ätzen zur Beseitigung von Defekten bei galvanische Teile zum Zweck ihrer Wiederverwendung in der Produktion sowie bei der Rückgewinnung von Metallplatten aus Offset-Bimetalldruckplatten.
Elektrochemisches Ätzen wird in der praktischen Materialwissenschaft häufig eingesetzt. Beispielsweise wurde das anodische Ätzen erfolgreich eingesetzt, um die Mikrostruktur einer Legierung beim metallografischen Fräsen sichtbar zu machen. In diesem Fall findet das Ätzen unter solchen Bedingungen statt, bei denen die Unterschiede in den Auflösungsgeschwindigkeiten der Komponenten der behandelten Legierung, die sich in Phase und chemischer Zusammensetzung unterscheiden, sehr deutlich zum Ausdruck kommen.
Selektives Ätzen hilft dabei, Phasengrenzen, die Segregation von Phosphor in Stahl, die dendritische Struktur von Titanlegierungen und das Netzwerk von Rissen bei der Chromgalvanisierung aufzudecken. Durch elektrochemisches Ätzen lässt sich zudem die Anfälligkeit von Edelstahl gegenüber interkristalliner Korrosion beurteilen.

